Il silicio e l’ossigeno costituiscono insieme il 74 % della massa e quasi il 95 % del volume della litosfera. Il silicio ha numero atomico 14; quindi nel nucleo sono presenti 14 protoni (ed altrettanti neutroni) e 14 elettroni esterni distribuiti su tre livelli energetici, dei quali il più interno è saturo con 2 elettroni e quello intermedio con 8; anche il guscio più esterno potrebbe essere saturato con 8 elettroni, ma in esso ve ne sono solo 4. Rimangono quindi 4 spazi disponibili.
Di conseguenza il comportamento chimico dell’atomo di silicio è condizionato dalla tendenza ad assumere altri 4 elettroni per saturare il guscio esterno. L’atomo di ossigeno ha numero atomico 8; due elettroni saturano il guscio interno, mentre gli altri 6 occupano quello esterno, che può essere saturato con altri due. La fig. 3.1 illustra i legami covalenti Si-O. I gusci elettronici esterni del silicio e di 4 atomi di ossigeno si fondono parzialmente. In questo modo il silicio avrà soddisfatta l’esigenza di possedere, in quel guscio, un ottetto elettronico completo. Gli atomi di ossigeno invece non raggiungono ancora il miglior equilibrio, dato che nel loro guscio esterno sono presenti 7 elettroni; ne manca ancora uno per la saturazione. L’unione di un atomo di silicio con quattro di ossigeno può essere rappresentata mediante l’espressione chimica “SiO4”
Simbolo periodico Si14
I silicati sono i minerali più diffusi sulla Terra (costituiscono, nelle diverse forme in cui si presentano – rocce magmatiche, sedimentarie, metamorfiche – più del 90% della crosta terrestre), e l'ossigeno e il silicio sono gli elementi più abbondanti nella crosta terrestre (rispettivamente, 46,6% e 27,7% in peso)
Numero atomico 14
Durezza 7
Dati Salienti
In caso di contatto con l’acqua, il silicio genera una pellicola di ossido passiva.
Il silicio è dopo l’ossigeno l’elemento più frequente sulla terra, tuttavia non è in grado di verificarsi nella sua forma elementare, ma si combina facilmente con l’ossigeno, formando silicati per esempio sabbia (biossido di silicio Sio2).
Lo strato di protezione Si14 è insolubile negli acidi, fatta eccezione per l’acido nitrico contenente acido fluoridrico.
In una soluzione alcalina calda il Silicio si scioglie formando legami di idrogeno e trasmissione di energia.
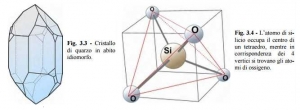
Ogni atomo di ossigeno del gruppo SiO4, per acquisire il miglior equilibrio chimico, si lega ancora con un altro atomo per saturare il livello energetico più esterno. Ogni atomo di ossigeno fa da ponte fra due atomi di silicio; il silicio è sempre circondato da 4 ossigeni. Contando il numero di atomi dei due elementi in tale struttura, si constata che l’ossigeno è in numero doppio rispetto al silicio. Questo composto ha dunque formula SiO2 e viene detto biossido di silicio o silice. Un esempio è il quarzo, minerale che (allo stato idiomorfo) si presenta con forme simili a quella indicata in fig. 3.3, rispecchiando l’ordine e la simmetria con cui gli atomi si dispongono nello spazio a formare il reticolo cristallino. Per soddisfare questa condizione occorre che l’angolo di legame Si-O sia di poco superiore a 105°.
In realtà l’atomo di silicio occupa il centro di un tetraedro i cui vertici sono occupati dai 4 ossigeni (fig. 3.4).
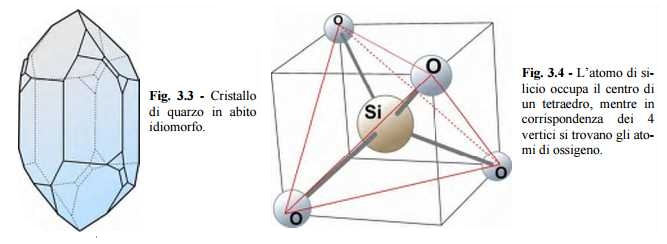
Nella fig. 3.5 sono riportati diversi schemi utili per una migliore comprensione della simmetria del tetraedro. Se il gruppo SiO4 non è disposto su un piano, ma costituisce una figura a tre dimensioni, l’unione di più tetraedri, che si dispongono nello spazio mettendo in comune i vertici, porta ad un reticolo cristallino caratterizzato dalla maggior complicazione che presuppone la terza dimensione. È importante sottolineare che la forma di tetraedro del gruppo SiO4 è la caratteristica più importante della silice e di numerose altre sostanze composte da silicio e ossigeno.
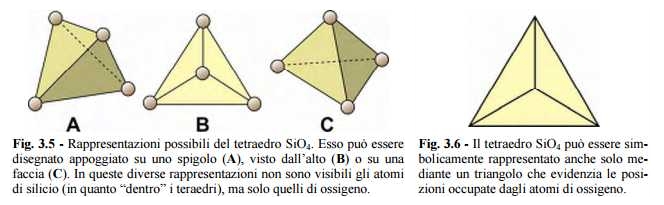
Nella maggior parte dei casi, data la complessità delle strutture cristalline, il tetraedro viene rappresentato come se fosse visto dall’alto (B in fig. 3.5), oppure come un semplice triangolo (fig. 3.6).